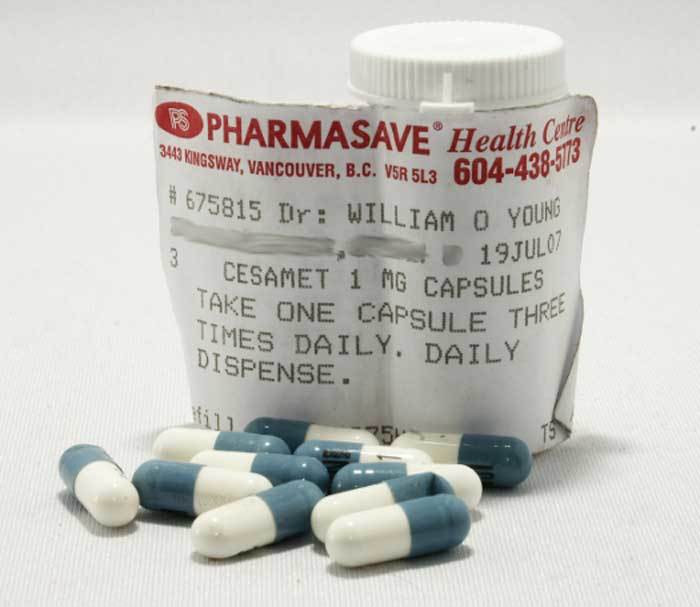
En el capítulo anterior repasamos la historia, propiedades, ventajas e inconvenientes del dronabinol, primer cannabinoide sintético utilizado en Medicina. Desde la década de los 80 se han sintetizado otros agonistas cannabinoides empleados en terapéutica humana. En este número revisaremos los dos más importantes: la nabilona y el rimonabant.
Como señalamos en el último capítulo, el dronabinol fue el primer cannabinoide obtenido en laboratorio, aunque en realidad se trata de una copia exacta del ∆-9-tetrahidrocannabinol (THC) que aparece de forma natural en la planta. Tanto esfuerzo en crear una copia artificial de un compuesto que podría extraerse de un vegetal sólo puede explicarse por los prejuicios hacia esta droga. Ya vimos como la vía de administración del dronabinol condicionaba unos efectos poco previsibles y limitaba sus aplicaciones.
Pero disponer de una molécula artificial de THC abre la puerta a poder crear “versiones mejoradas” que puedan conseguir mejores efectos terapéuticos. Ésta es una de las propiedades maravillosas de la química y la farmacología: pequeñas modificaciones de uno o unos pocos átomos en una molécula pueden causar diferencias muy grandes de efectos, ya sean terapéuticos, recreativos o tóxicos. Por ejemplo, añadir dos átomos de oxígeno y uno de carbono en una posición concreta transforma a la metanfetamina, un estimulante de duración larga y efectos potentes en la 3,4-metilendioximetanfetamina (MDMA, éxtasis), una sustancia con propiedades selectivas sobre las emociones y el miedo. Y un único átomo de oxígeno es lo que separa al etanol (el alcohol que se encuentra en vino, cerveza o licores) del metanol, compuesto tóxico para el nervio óptico que puede dejar completamente ciega a una persona si se administra a las dosis suficientes. En el campo de la farmacología humana el caso más evidente es el de las insulinas. A partir de la molécula original de la insulina humana y mediante pequeñas modificaciones se han comercializado decenas de derivados con distintas potencias y duración de efectos que han contribuido de forma significativa a incrementar la calidad y esperanza de vida de los pacientes diabéticos.
A estas “versiones mejoradas” de una determinada molécula se las conoce en química con el nombre de “análogos”. Cuanto más compleja sea una molécula, mayores son las posibilidades de acortar, añadir o sustituir átomos y cadenas en busca de un efecto determinado. Es importante señalar que estos procesos son extraordinariamente complicados desde un punto de vista técnico y económico. En primer lugar, los químicos tienen que idear, muchas veces partiendo desde cero, la ruta de síntesis química de un análogo determinado, lo que no es técnicamente posible en todos los casos. Después estos compuestos experimentales tienen que probarse en cultivos celulares, más tarde en animales de experimentación y, finalmente, en el caso de que todos los pasos anteriores hayan sido satisfactorios, comenzar a ser experimentados en humanos, donde deberán mostrar un beneficio significativo con efectos secundarios aceptables y pocos efectos tóxicos. Todo este proceso implica inversiones astronómicas y mucho tiempo (en bastantes casos más de una década), lo que sólo está al alcance de la potente industria farmacéutica.
En el caso de la molécula del THC, sus tres anillos dejan catorce posiciones libres, con lo que las posibilidades son casi infinitas. Desde mediados de la década de los 70 del siglo pasado, una vez establecida su estructura química, distintos laboratorios farmacéuticos han investigado en busca de nuevos cannabinoides útiles en terapéutica humana. En 1975 se había descubierto ya que un análogo del THC, el 9-nor-9-beta-hidroxi-hexahidrocannabinol (HHC) era un cannabinoide mucho más selectivo para el dolor que el propio THC. Partiendo de ese modelo, la compañía Pfizer (productora de greatest hits de la farmacología humana como Trankimazin®, Viagra® o la vacuna BCG para la tuberculosis) patentó cientos de cannabinoides sintéticos y, a principios de la década de los 80 se lanzó a estudiar un cannabinoide llamado levonantradol, que iba a ser comercializado con el nombre de Nantrodolum®.
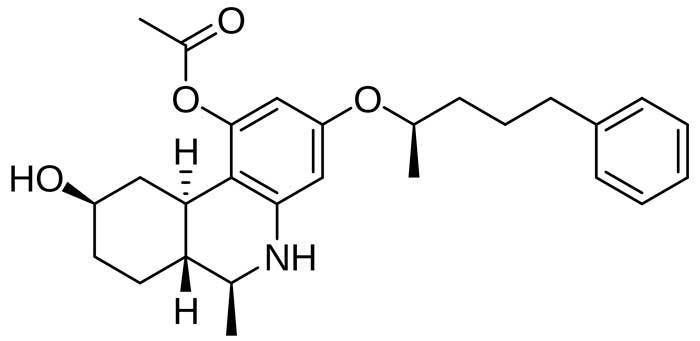
Los primeros estudios in vitro y en animales de experimentación fueron satisfactorios. Los científicos se mostraban extrañados, porque el levonantradol producía efectos psicotrópicos y quitaba el dolor en animales, pero no lo hacía de la forma en la que actúan los analgésicos tradicionales y los opiáceos. Hay que tener en cuenta que, entonces, todavía no se conocía que el cannabis y los cannabinoides actúan sobre los receptores específicos que conforman el Sistema Cannabinoide Endógeno, que fue descubierto una década después. El fármaco tenía además la ventaja de poder ser administrado por vía intramuscular, lo que teóricamente supondría que podría alcanzar mejor sus objetivos que el THC. Así, entre 1981 y 1984, el levonantradol fue evaluado en ensayos clínicos en humanos, buscando conocer su eficacia en el dolor postoperatorio y en las nauseas y vómitos asociados a quimioterapia, dos de las utilidades del THC sintético y en las que, partiendo de los resultados en animales, era previsible encontrar éxito. Estos estudios mostraron que el levonantradol era eficaz, es decir, conseguía disminuir el dolor o las náuseas, pero lo hacía en menor medida que otros fármacos disponibles en aquel momento. Además, aparecían otro tipo de problemas inesperados, como dolor intenso en el lugar de la inyección, efectos psicológicos desagradables y bajadas de tensión. En un estudio sobre 22 pacientes, más de la mitad (14) presentaron alguna de estas complicaciones. Para que un fármaco sea aprobado por las autoridades sanitarias no basta con que este sea útil, sino que tiene que aportar mejorías y/o menos efectos adversos que otros ya conocidos. Por estos motivos el levonantradol nunca fue comercializado. Quedó como un fármaco experimental o, como mucho, se usó forma compasiva en enfermos en los que todas las demás opciones posibles habían fallado.
Por las mismas fechas, otro científico, Louis Lemberger, trabajaba para Lilly (otro gigante de la industria farmacéutica) en un programa de investigación sobre cannabinoides sintéticos. Éste científico había descubierto que, en los humanos, el ∆-9-THC sufre una modificación en el hígado después de su administración, dando lugar a otro compuesto (que básicamente es el mismo THC, con un átomo de oxígeno e hidrógeno agregados), que tiene mayores efectos en el organismo. Siguiendo esta línea de investigación, pronto se descubrió que un cannabinoide sintético, muy similar al THC con dos pequeñas modificaciones, tendría efectos más potentes que el propio THC y se podría administrar mejor por vía oral.
Este cannabinoide, llamado nabilona, superó los estudios en animales y comenzó a administrarse a humanos de forma experimental. Se descubrió que era activo por vía oral en voluntarios sanos a dosis de 0.5-1mg (dos o tres veces más potente que el THC) y que algunos de sus efectos adversos (bajadas de tensión arterial y efectos psicológicos) cedían al administrarla durante varios días seguidos. El efecto adverso de “euforia” se presentaba con menos frecuencia que con el THC, lo que según el punto de vista de los investigadores era una ventaja sobre el principio activo del cannabis. Podríamos discutir por qué los médicos tendemos a considerar la euforia, que etimológicamente significa “sentirse bien”, como un efecto negativo de los fármacos, pero eso nos llevaría a salirnos del tema, por lo que lo dejaremos para otra ocasión. Como decíamos, estos resultados llevaron a probar el fármaco en distintas enfermedades, y nuevamente las nauseas y vómitos asociados a quimioterapia fueron el primer objetivo, puesto que tanto el THC como el cannabis son eficaces en este sentido. Los investigadores en este caso tuvieron más suerte que los de Pfizer, y en 1979 la prestigiosa revista médica New England Journal of Medicine publicaba el primer estudio en el que se mostraba que la nabilona era más eficaz que los tratamientos previos para el control de estos síntomas. Dos investigaciones posteriores con más pacientes corroboraron, en 1980 y 1982, estos resultados.
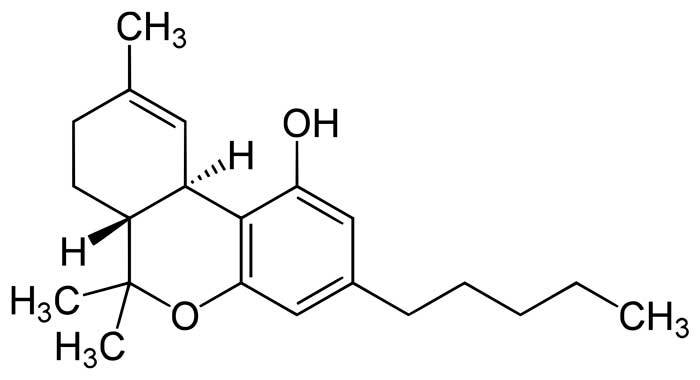
La nabilona fue inicialmente estudiada en algunas indicaciones más con menor éxito. El cannabis produce efectos broncodilatadores (“abre los pulmones”) pero la vía de administración fumada imposibilita su uso en el tratamiento del asma o la bronquitis crónica. La nabilona era eficaz por vía oral por lo que evitaría este inconveniente, pero, en la práctica, se demostró que el efecto era menor que el de los inhaladores habituales y que, incluso en algunos casos, producía un efecto contrario al esperado. También se sabía que el cannabis disminuye la presión dentro de una de las cavidades del ojo humano, cuyo incremento da lugar a una enfermedad llamada glaucoma. La nabilona también producía este efecto, pero para la mayoría de los pacientes (fundamentalmente gente anciana) los efectos psicológicos eran demasiado rotundos y el tratamiento en forma de colirios resultaba menos sobrecogedor.
A mediados de los 80 el laboratorio presentó todos estos informes a las autoridades sanitarias norteamericanas (la FDA, Food And Drug Administration), canadienses y del Reino Unido, con la idea de comercializar el fármaco. En Estados Unidos la FDA dio pronto su visto bueno, pero se topó con la oposición de la DEA (Drug Enforcment Agency, agencia antidroga norteamericana). Los informes científicos demostraban claramente que el potencial de abuso y dependencia de la nabilona era bajo, pero los chicos de la DEA decidieron pasarse los datos objetivos por alto y mantuvieron sin argumentos que la nabilona era muy adictiva. En general, los organismos antidroga están compuestos de políticos, agentes del orden y de la moral a sueldo y presentan una tendencia innata a meter sus hocicos en los asuntos estrictamente sanitarios, que en la mayoría de los casos no están capacitados para comprender. Así, cualquier dato de investigación científica que huela, aunque sea lejanamente a “la droga” tiene muchas posibilidades de ser anulado por esta especie de modernos Tribunales de la Inquisición.
En el Reino Unido, Canadá y México, sin embargo, las autoridades fueron más sensatas. A la vista de los datos científicos decidieron autorizar la comercialización del fármaco (con el nombre de Cesamet®), aunque lo sometieron a una vigilancia especial en espera de la aparición de casos de abuso, dependencia o problemas psiquiátricos. Tres décadas después estos problemas no se han presentado y la nabilona es una opción terapéutica más entre las disponibles.
El hecho de que la nabilona sea un fármaco como cualquier otro en ciertos países, ha facilitado su investigación para otras indicaciones. En México, por ejemplo, está aprobado para el tratamiento del dolor crónico, basándose en investigaciones científicas validadas. Existen ensayos clínicos que muestran su utilidad en síntomas del cáncer distintos a las nauseas, como la pérdida de peso, el dolor o los síntomas de ansiedad y depresión. Otros estudios han mostrado que puede ser eficaz en el alivio de los efectos secundarios que producen las medicaciones para la enfermedad de Parkinson, los síntomas de la esclerosis múltiple o las pesadillas que se presentan en personas con trastorno por stress postraumático.
A pesar de que en Estados Unidos la nabilona sigue clasificada en la restrictiva “Lista II”, en 2006 se comenzó su comercialización con 20 años de retraso. En España sólo es accesible como medicación extranjera con informe de especialista. Es muy probable que todas estas restricciones no existieran si la molécula no estuviera emparentada con la planta del cannabis. Aunque objetivamente y en el momento actual la nabilona es un fármaco de utilidad limitada, no debemos olvidar que los medicamentos van encaminados a mejorar la salud o aliviar el sufrimiento de las personas. Poner por delante condicionamientos de tipo moral es, sencillamente, una actitud repugnante.
Acerca del autor
Muchos años luchando en la sombra para que el cannabis florezca al sol.